Gamme Respiratory Multi Well System MWS R-GENE®
Une gamme de trousses de PCR* en temps réel destinées à détecter des agents infectieux impliqués dans les maladies respiratoires
- Diagnostic « à la carte » grâce à une solution modulaire des tests PCR* duplex
- Réactifs prêts à l’emploi comprenant des contrôles positif et négatif
- CE-IVD sur l’ensemble des principales plates-formes d’extraction et des systèmes de PCR en temps réel
Ajouter à ma sélection
Avez-vous besoin de plus d'informations?
Gamme Respiratory MWS R-GENE®
Grâce à un large choix de produits, la gamme de trousses de PCR en temps réel Respiratory MWS R-GENE® permet de détecter plus de 35 pathogènes respiratoires impliqués dans des maladies respiratoires :
- Influenza A/B R-GENE®
- RSV/hMPV R-GENE®
- Rhino&EV/Cc R-GENE®
- AdV/hBoV R-GENE®
- Chla/Myco pneumo R-GENE®
- HCoV/HPIV R-GENE®
- Legio pneumo/Cc R-GENE®
Avantages de respiratory MWS R-GENE®
Les infections respiratoires aiguës (IRA) représentent environ 75 % de la morbidité aiguë dans les pays industrialisés, et constituent encore la principale cause de maladies aiguës dans le monde. Les pneumopathies les plus graves et potentiellement mortelles touchent surtout les jeunes enfants, les personnes âgées, ainsi que les personnes immunodéprimées ou fragilisées (comme les patients atteints d’une maladie chronique ou d’un cancer, ou ceux se trouvant en unités de soins intensifs). La grande majorité des maladies respiratoires est causée par des bactéries et des virus. La symptomatologie étant similaire, il est essentiel de procéder à des tests diagnostiques appropriés pour identifier les agents infectieux.
Une détection optimisée de ces agents infectieux est nécessaire si l’on veut garantir une prise en charge optimale du patient et prévenir la propagation des infections.
- Solution modulaire multiplex
- Permet d’adopter une stratégie de diagnostic ciblée grâce à un choix « à la carte »
- Permet de choisir les pathogènes à tester selon la saison
- Offre la possibilité de diagnostiquer les co-infections
- Sensible et reproductible
- Détection fiable des agents infectieux impliqués dans les maladies respiratoires
- Tous contrôles inclus (contrôle positif et négatif, contrôle cellulaire)
- Standardisé
- Protocole uniforme pour les cibles ADN et ARN
- Traitement en parallèle de plusieurs analyses pour les pathogènes respiratoires à l’aide de la gamme Respiratory MWS R-GENE®
- Profils de tests harmonisés pour procéder simultanément à plusieurs essais
- Flexible
- Gamme validée pour une utilisation avec différents types d’échantillons respiratoires
- Compatible avec plusieurs systèmes de préparation d’échantillons automatisés, y compris NucliSENS® easyMAG®
- Préparation des réactions PCR* manuelle ou automatisée par le robot de pipettage easySTREAM®
- Gamme qualifiée pour les principales plates-formes de PCR* en temps réel
Une trousse complète contenant tout ce dont vous avez besoin
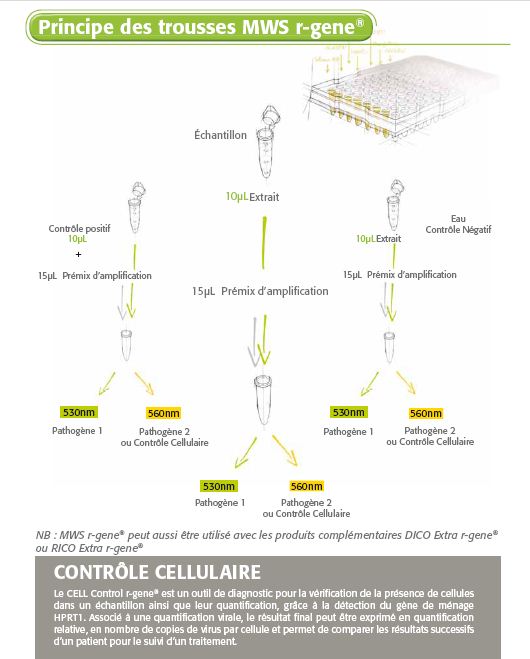
Les trousses Respiratory MWS R-GENE® sont des trousses moléculaires prêtes à l’emploi pour la détection de pathogènes par PCR en temps réel après extraction de l’ADN/ARN viral. Cette technologie 5’ nucléase Taqman amplifie et détecte simultanément une région spécifique du génome du pathogène.
- Contrôle cellulaire pour valider la qualité de l’échantillon pour certaines trousses
- Contrôle négatif et contrôle positif spécifique à un pathogène
- Inclut tous les réactifs nécessaires optimisés pour détecter des pathogènes à des fins de diagnostic in vitro
Une procédure simple
Il suffit d’ajouter l’échantillon d’ADN ou d’ARN extrait au prémix d'amplification PCR* prêt à l’emploi et de commencer la réaction sur le thermocycleur de PCR* en temps réel approprié, en suivant le programme de cycles optimisé décrit dans les « Instructions d’utilisation » de la Notice Technique.
*PCR = Polymerase Chain Reaction (en français Réaction en Chaine par polymérase)
BIOMERIEUX, le logo bleu, ARGENE®, R-GENE®, EASYMAG® et NUCLISENS® sont des marques utilisées, déposées et/ou enregistrées appartenant à bioMérieux, ou à l’une de ses filiales, ou à l’une de ses sociétés. Les autres marques et noms de produits mentionnés appartiennent à leurs propriétaires respectifs.
Influenza A/B R-GENE®
| INFLUENZA A/B R-GENE® (71-040) | |
|---|---|
| Principe du test | Amplification et détection en duplex des virus Influenza A et Influenza B |
| Références de commande | Référence 71-040 : Influenza A/B R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | Influenza A : Gène M
Influenza B : Gène M
|
| Échantillon*** | Échantillons respiratoire (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection (sur DX Real-Time System (Bio-Rad)) |
Sur prélèvement nasopharyngé : Influenza A : LoD** 95 % : 199,5 TCID50/mL Influenza B : LoD** 95 % : 1,7 TCID50/mL
|
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | Applied Biosystems 7500 Fast, StepOne Dx Real-Time System LightCycler 480 System II Stratagene / Agilent/ VERSANT kPCR Molecular System AD RotoR-GENE |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
RSV/hMPV R-GENE®
| RSV/HMPV R-GENE® (71-041) | |
|---|---|
| Principe du test | Amplification et détection en duplex des RSV (A&B) et des hMPV (A&B) |
| Références de commande | Référence 71-041: RSV/hMPV R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | RSV : Gène N
hMPV : Gène M
|
| Échantillon*** | Échantillons respiratoires (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection (sur DX Real-Time System (Bio-Rad)) |
Sur prélèvement nasopharyngé : hMPV A : LoD** 95 % : 2041,7 TCID50/mL hMPV B : LoD** 95 % : 4466,8 TCID50/mL RSV A : LoD** 95 % : 2,0 TCID50/mL
|
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | LightCycler 480 System II RotoR-GENE Applied Biosystems 7500 Fast, StepOne Stratagene / Agilent / VERSANT kPCR Molecular System AD Dx Real-Time System |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
Rhino&EV/Cc R-GENE®
| RHINO&EV/CC R-GENE® (71-042) | |
|---|---|
| Principe du test | Amplification et détection en duplex des Rhinovirus (A,B,C) et des Entérovirus (A,B,C,D) et contrôle cellulaire |
| Références de commande | Référence 71-042: Rhino&EV/Cc R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | Rhinovirus et Entérovirus : région 5’ non codante Contrôle cellulaire : Gène HPRT1 |
| Échantillon*** | Échantillons respiratoires (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection (sur DX Real-Time System (Bio-Rad)) |
Prélèvement nasopharyngé : Rhinovirus 14 LoD** 95 % : 0,43 TCID50/mL Prélèvement nasopharyngé :
Entérovirus (échovirus 25) LoD** 95 % : 37,96 TCID50/mL |
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | LightCycler 480 System II RotoR-GENE Applied Biosystems 7500 Fast, StepOne Stratagene / Agilent/ VERSANT kPCR Molecular System AD Dx Real-Time System |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
AdV/HBoV R-GENE®
| ADV/HBOV R-GENE® (71-043) | |
|---|---|
| Principe du test | Amplification et détection en duplex des Adénovirus (A,B,C,D,E,F,G) et des Bocavirus (hBoV 1,2,3,4) |
| Références de commande | Référence 71-043 : AdV/hBoV R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | Adénovirus : Gène EXON
Bocavirus : Gène NS1 ou VP1
|
| Échantillon*** | Échantillons respiratoires (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection | Prélèvement nasopharyngé AdV3 : LoD** 95 % : 800 copies/mL Prélèvement nasopharyngé hBoV1 :
LoD** 95 % : 900 copies/mL |
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | LightCycler 480 System II RotoR-GENE Applied Biosystems 7500 Fast, StepOne Stratagene / Agilent / VERSANT kPCR Molecular System AD Dx Real-Time System |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
Chla/Myco pneumo R-GENE®
| CHLA/MYCO PNEUMO R-GENE® (71-044) | |
|---|---|
| Principe du test | Amplification et détection en duplex de Chlamydia pneumoniae et de Mycoplasma pneumoniae |
| Références de commande | Référence 71-044 : Chla/Myco pneumo R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | Chlamydia pneumoniae : Gène OMP2
Mycoplasma pneumoniae : Gène P1
|
| Échantillon*** | Échantillons respiratoires (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection | Prélèvement nasopharyngé Chlamydia pneumoniae : LoD** 95 % : 0,26 UFI/mL Prélèvement nasopharyngé Mycoplasmapneumoniae :
LoD** 95 % : 200 UCC/mL UFI : unités formant inclusions
UCC : unité de changement de couleur
|
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | LightCycler 480 System II RotoR-GENE Applied Biosystems 7500 Fast, StepOne Stratagene / Agilent / VERSANT kPCR Molecular System AD Dx Real-Time System |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
HCoV/HPIV R-GENE®
| HCOV/HPIV R-GENE® (71-045) | |
|---|---|
| Principe du test | Détection en duplex des Coronavirus humains (NL63, OC43, HKU1, 229E) et des Parainfluenzavirus (HPIV1, HPIV 2, HPIV 3 et HPIV4). |
| Références de commande | Référence 71-045 : HCoV/HPIV R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | HCoV : Gène N HPIV : Gène N |
| Échantillon*** | Échantillons respiratoires (aspiration nasopharyngée, écouvillonnage nasal, lavage nasal, liquide broncho-alvéolaire) |
| Limite de détection |
Dans un prélèvement nasopharyngé : Coronavirus 229E : LoD** 95 % : 0,20 TCID50/mL Coronavirus OC43 : LoD** 95 % : 86,85 TCID50/mL
Coronavirus NL63 : LoD** 95 % : 0,002 TCID50/mL
Coronavirus HKU1 : LoD** 95 % : 18,07 copies/mL
Parainfluenza 1 : LoD** 95 % : 379,79 TCID50/mL
Parainfluenza 2 : LoD** 95 % : 529,93 TCID50/mL
Parainfluenza 3 : LoD** 95 % : 245,28 TCID50/mL
Parainfluenza 4 : LoD** 95 % : 0,21 TCID50/mL
|
| Contrôles inclus | Contrôle positif, contrôle négatif |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact QIAsymphony SP |
| Plate-forme d’amplification validée*** | LightCycler 480 RotoR-GENE Applied Biosystems 7500 Fast, StepOne Stratagene / Agilent / VERSANT kPCR Molecular System AD Dx Real-Time System |
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
***Veuillez vous renseigner
Legio pneumo /Cc R-GENE®
| LEGIO PNEUMO R-GENE® (71-046) | |
|---|---|
| Principe du test | Amplification et détection en duplex de Legionella pneumophila (15 sérogroupes, y compris sérogroupe 1) et contrôle cellulaire |
| Références de commande | Référence 71-046 : Legio pneumo/Cc R-GENE® |
| Technologie | PCR* en temps réel / Technologie des sondes d’hydrolyse 5’ nucléase Taqman |
| Gène cible | Legionella pneumophila : Gène MIP
Contrôle cellulaire : Gène HPRT1
|
| Échantillon*** | Lavage broncho-alvéolaire, aspirations trachéo-bronchiques et crachats |
| Limite de détection |
Sur Dx Real-Time System (Bio-Rad) :
Legionella pneumophila : LoD** 95 % : 48,3 UFC/mL
Legionella pneumophila sérogroupe 1 dans les sécrétions nasopharyngées sur ABI 7500 Fast (Applied Biosystems) :
LoD** 95 % : 58,2 UFC/mL
UFC : Unité formant colonies
|
| Contrôles inclus | Contrôle positif, contrôle négatif, contrôle cellulaire |
| Délai d’obtention des résultats | 90 minutes (étape d’extraction exclue) |
| Unité de mesure | Test qualitatif |
| Nombre de tests | 60 tests |
| Conditions de conservation | -18°C/-22°C |
| Plate-forme d’extraction automatisée validée*** | NucliSENS® easyMAG® MagNA Pure Compact |
| Plate-forme d’amplification validée*** |
Applied Biosystems 7500 Fast, 7500 Fast Dx, ViiA7 (blocks for 96 well and Fast 96 well plates), StepOne
LightCycler 480 System II
RotoR-GENE
Dx Real-Time System
Stratagene / Agilent/ VERSANT kPCR Molecular System AD
|
| Statut | A utiliser pour le diagnostic in vitro, marquage CE en Europe |
*PCR = Polymerase Chain Reaction (en français Réaction en Chaine par polymérase)
**LoD = Limit of detection (en français Limite de détection)
**LoD = Limit of detection (en français Limite de détection)
***Veuillez vous renseigner
Quelques informations sur les pathogènes respiratoires
Qu'est ce que les pathogènes respiratoires ?
Les infections respiratoires hautes, telles que les rhinites, pharyngites et laryngites font partie des maladies les plus communes chez l’enfant. Elles peuvent également conduire à des exacerbations de l’asthme, à des otites sévères et à des infections basses du tractus respiratoire telles que bronchite, bronchiolite et pneumonie.
La quasi-totalité de ces infections respiratoires est d’origine bactérienne ou virale. Les virus Influenza A et B, le virus Parainfluenza de types 1, 2 et 3, le Virus Respiratoire Syncytial (VRS A et B), les Adenovirus et les Rhinovirus sont les causes principales d’infections respiratoires sévères.
D’autres pathogènes, tels que les Coronavirus, Bocavirus, Enterovirus, Parainfluenzavirus de type 4, Metapneumovirus, Mycoplasma pneumoniae, Chlamydophila pneumoniae et Legionella pneumophila,infectent également le tractus respiratoire et peuvent aussi conduire à des infections pulmonaires graves voire fatales.
Population à risque
Les jeunes enfants, les personnes âgées, ainsi que les personnes immunodéprimées ou fragilisées (comme les patients atteints d’une maladie chronique ou d’un cancer, ou ceux se trouvant en unités de soins intensifs).
Quels sont les avantages du test moléculaire pour les infections respiratoires ?
Avec une diversité de pathogènes très importante pour des symptomatologies souvent similaires, la discrimination de l’agent infectieux en cause reste une des difficultés majeures du diagnostic des infections respiratoires.
Une identification précoce de l’agent infectieux s’avère indispensable pour un meilleur pronostic de guérison et un recours optimisé aux traitements antibiotiques tout en empêchant la dissémination de la maladie. Pour assurer ce diagnostic rapide et précoce, la PCR en temps réel est une technique de choix.
Respiratory MWS R-GENE®: PUBLICATIONS & POSTERS
- Identification Of Viral Pathogens Responsible For Severe And Complicated Respiratory Infection During The Pandemic And Post-Pandemic Period (2009-2011)
Marta Canuti et al. Department of Biomedical Sciences for Health, Università degli Studi di Milano, Milan, Italy. ECV 2013 - Development of a new diagnostic tool for the detection of Human Coronaviruses & Human Parainfluenzaviruses in a duplex RT PCR
Jérôme Bes et al. bioMérieux. ECV 2013 - Development of a new diagnostic tool for the detection of Rhinovirus/Enterovirus and Cellular control in a duplex RT PCR
Bes et al. ARGENE. Europic 2012 - Development of a new diagnostic tool for the detection of Chlamydophila pneumoniae and Mycoplasma pneumoniae in a duplex real-time PCR
Bertrand et al. ARGENE. ECCMID 2012 - Respiratory Multi Well System (MWS) R-GENE™ : simultaneous detection of infectious agents involved in respiratory diseases
Magro et al. ARGENE. CVS 2011 - Respiratory Multi Well System (MWS) R-GENE™ : simultaneous detection of infectious agents involved in respiratory diseases
Résa et al. ARGENE. ESCV 2011 - Development of a new diagnostic tool for the detection of Chlamydophila pneumoniae and Mycoplasma pneumoniae in a duplex real-time PCR
Bertrand et al. ARGENE. ESCV 2011 - Comparative Evaluation of Six Commercialized Multiplex PCR Kits for the Diagnosis of Respiratory Infections
Sylvie Pillet1., Marina Lardeux1., Julia Dina2, Florence Grattard1, Paul Verhoeven1, Jérôme Le Goff3,Astrid Vabret2, Bruno Pozzetto1*
August 2013 | Volume 8 | Issue 8 | e72174